杨晓光:中国特殊医学用途食品法规现状与展望
特殊医学用途配方食品的定义和作用
特殊医学用途食品应该说还是一个新事物。虽然法规体系已经建立了起来,但是真正上市的产品目前还不是很多。特殊医学用途食品是为了满足进食受限、消化吸收障碍、代谢紊乱或特别疾病状态人群对营养或膳食的特殊需要,专门加工配制而生的配方食品。当目标人群无法进食普通膳食或无法用日常膳食满足其营养需求时,特殊医学用途配方食品可以作为一种营养补充途径,起到营养支持作用。同时针对不同疾病的特异性代谢状态,对相应的营养素含量提出了特别规定,能更好的适应特定疾病状态或疾病某一阶段的营养需求,为患者提供有针对性的营养支持。
大量的临床研究已经表明特殊医学用途配方食品可以减少患者的医疗费用,改善最后的结局。该类产品在各国均作为特殊膳食用食品进行管理,但名称有所不同。特殊医学用途配方食品最早进入中国时,都是以药品注册的。目前该类产品更多的是以药的形式在我国临床上使用,有别于其他国家。
国际标准与法规现状
国际食品法典委员会(Codex Alimentarius Commission)将特殊医学用途食品命名为Food for Special Medical Purpose(FSMP)。在CODEX标准中,FSMP是指“特殊加工或配方的,用于患者的膳食管理,只能在医学监督下使用的一种特殊膳食用食品。这类食品目标人群是进食、消化、吸收或者代谢普通食品或其含有的特定营养素能力受限或降低的患者,或者由于疾病导致的营养素需求改变的患者,其膳食管理仅依靠正常膳食调节、使用其他特殊膳食用食品或者二者组合均无法达到目的时,作为这些人群的全部的或部分的营养来源的食品”。
美国把该类食品命名为Medical foods,定义跟CODEX相似,共分为四类:一类叫全营养配方,以这类食品为单一营养源可以满足全部的营养需要;第二类叫非全营养配方,在食用前与其它产品充分混合,如蛋白质、碳水化合物和脂肪;另外还有用于1岁以上的代谢紊乱病人的配方食品和口服的补水产品。
美国对Medical foods原料的管理方法是:食品添加剂应该经过FDA的批准;营养物质应当作为公认安全物质GRAS进行评估;新成分应当进行新食品添加剂申报或GRAS评估。Medical foods在美国上市前不需要任何的注册和批准,但是,美国对生产监管很严格,生产厂应当符合良好生产规范,FDA每年要对注册工厂进行实地的考察。
欧盟对于FSMP的定义与CODEX一致,根据1999/21/EC,欧盟FSMP分为三类,一类是全营养标准配方食品,一类是针对某种疾病或临床要求的全营养特定配方食品,第三类是非全营养配方或特定配方食品。欧盟对于FSMP原料的管理方法是:食品添加剂及质量规格需符合欧盟的食品添加剂通用标准;营养素强化剂需符合欧盟标准 “可用于特殊营养目的用食品中的添加物质”;新成分应当进行食品添加剂申报或新资源食品申报。欧盟对FSMP的标识有特殊的要求,上市不需要审批,但是要对成员国进行通报,只允许在医院、药店和康复中心进行销售。
在日本,特殊医学用途食品叫做病人用特殊食品(FOSDU),它又分为两类:病人用标准配方食品和需要个别审批的食品。它们有着不同的审批规程,标准配方食品是按标准来审批,个别审批食品是按照个案来审批。
总体来说,各个国家对于特殊医学用途食品的标准是与本国国情相适应的,它们在内容上略有区别:
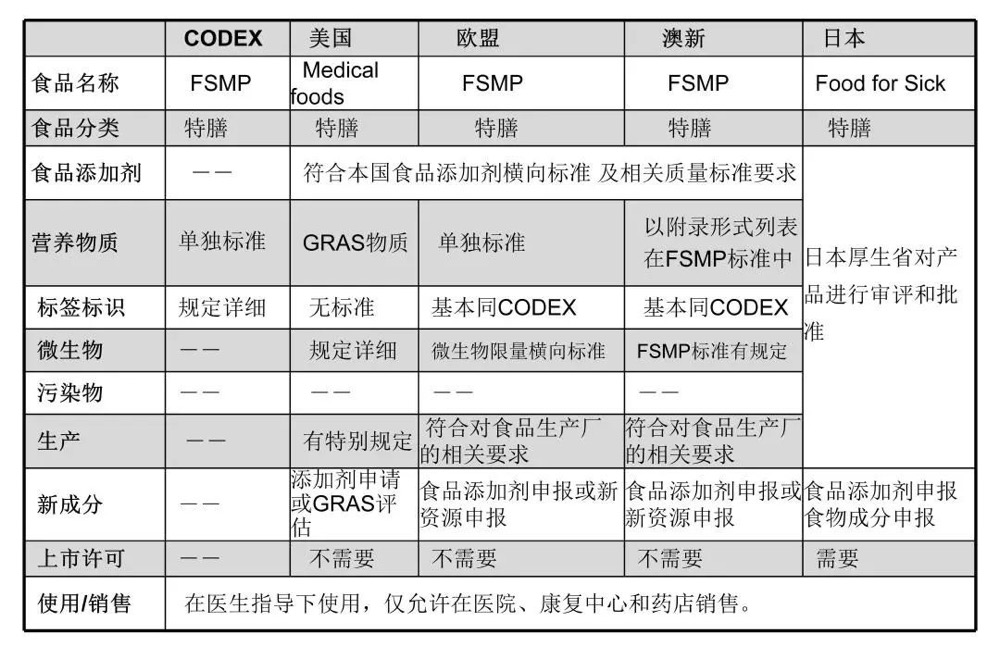
图1 各国FSMP标准的对比
我国标准现状和进展
我们国家对于特殊用医学食品有一个规范+两个标准,分别是《特殊医学用途配方食品良好生产规范》(GB29923-2013)、《特殊医学用途婴儿配方食品通则》(GB25596-2010)和《特殊医学用途配方食品通则》(GB29922-2013)。
《特殊医学用途婴儿配方食品通则》于2012年最早实施。我国特殊医学用途婴儿配方食品分为六大类,分别是无乳糖配方或低乳糖配方、乳蛋白深度水解配方或氨基酸配方、氨基酸代谢障碍配方、乳蛋白部分水解配方、早产/低出生体重婴儿配方和母乳营养补充剂。其中氨基酸配方障碍配方可以对一些苯丙酮尿症或者特殊氨基酸代谢障碍患者使用,母乳营养补充剂是与母乳配合使用,可满足早产/低出生体重儿的生长发育需求。
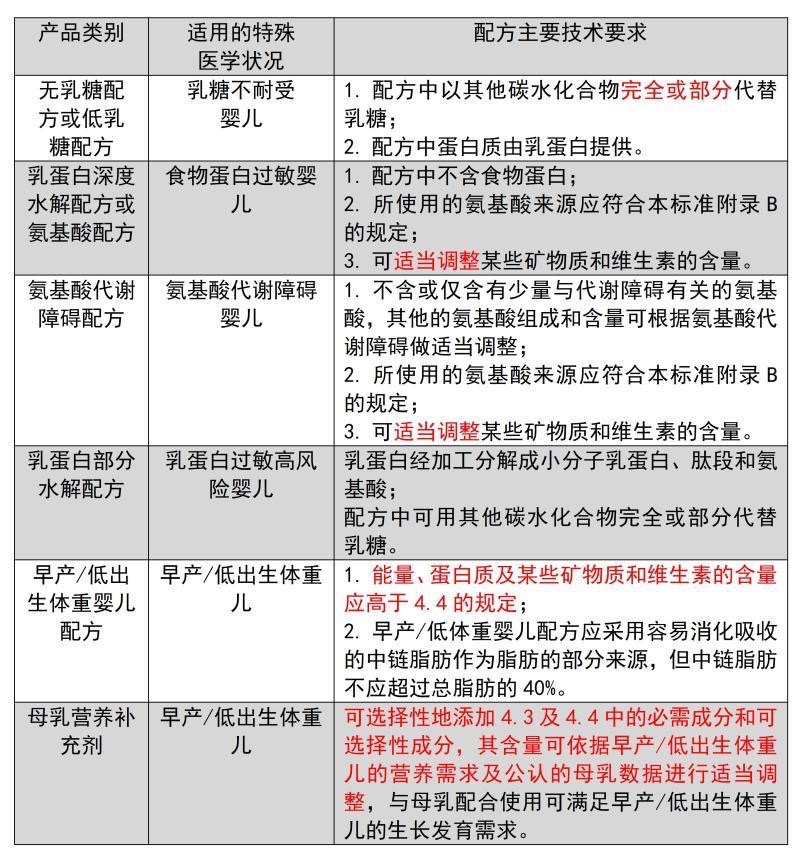
图2 GB25596-2010列出的产品类别、适用的特殊医学状况和配方主要技术要求
对于《特殊医学用途配方食品通则》,我国参考了欧盟FSMP标准,把它分为3类:一是全营养配方食品,分为1-10岁人群及10岁以上人群;二是特定全营养配方食品,这是针对糖尿病病人、肿瘤病人、肾脏病人等特殊人群的需求设计的;三是非全营养配方食品,可满足目标人群部分营养需求的特殊医学用途配方食品,不适用于作为单一营养来源。
从基本要求来看,特殊医学用途配方食品的配方应以医学和(或)营养学的研究结果为依据,其安全性及临床应用(效果)均需要经过科学证实;特殊医学用途配方食品的生产条件也应符合国家有关规定。
目前特殊医学用途配方食品已经随着《中华人民共和国食品安全法》的实施入“法”。国家对特殊医学用途配方食品实行严格监督管理,该类食品应当经国务院食品药品监督管理部门注册。注册时,应当提交产品配方、生产工艺、标签、说明书以及表明产品安全性、营养充足性和特殊医学用途临床效果的材料。
展望
目前《特殊医学用途配方食品通则》还需要进一步理顺几个方面的工作。一是需要厘清与《特殊医学用途婴儿配方食品通则》的关系,后者由于对临床验证没有要求,导致两个通则无法衔接起来; 二是要确认通则中特定全营养配方食品与已立项的单独特定全营养配方食品标准的关系,目前还有四类食品尚未单独立项,分别是食物蛋白质过敏全营养配方食品、肥胖减脂手术全营养配方食品、胃肠道吸收障碍、胰腺炎病人用全营养配方食品和脂肪酸代谢异常病人用全营养配方食品。特定全营养应该根据特定全营养配方食品的标准,制定其营养配方,以满足目标人群的营养需求,对尚无具体标准的特定全营养配方食品,应以医学和(或)营养的研究结果为依据指定营养配方;三是疏理现有产品,分析营养指标,尽可能明确各组件范围并细化技术指标,比如增加膳食纤维组件等。

