饮食干预作为抗癌疗法的基础、现状和未来
目前的研究表明,预防癌症的重要手段之一是饮食调节。饮食可以在几乎所有方面影响肿瘤的发生、发展和治疗反应。最近的临床前模型和早期临床研究表明饮食干预是一种潜力巨大的癌症治疗方法,特定的饮食可以在预防肿瘤、延缓肿瘤生长和提高现有癌症治疗效果方面发挥重要作用。然而,由于人们对饮食疗法的潜在机制了解有限,这些潜在的癌症治疗方法常常被忽视。
首都医科大学附属北京世纪坛医院石汉平教授团队结合近年来的研究成果,介绍了饮食对肿瘤进展的影响以及如何将这些信息转化为抗癌治疗的实践。

近日发表在《Trends in Molecular Medicine》上的综述文章,介绍了饮食对肿瘤进展的影响以及如何将这些信息转化为抗癌治疗的实践。
一、饮食干预治疗肿瘤的基础
1、肿瘤所需营养物质的特点
肿瘤的遗传异质性及其起源组织的不同代谢特征导致癌细胞偏爱特定的营养素,容易受到营养摄入量变化的影响。瓦伯格效应(Warburg effect)描述了肿瘤细胞在肿瘤发生过程中可以从氧化代谢转变为糖酵解代谢以快速适应低氧、酸性、营养物质缺乏等微环境而快速增殖的现象。因此,癌细胞通常倾向于将葡萄糖作为产生能量的主要营养素。霍夫曼效应描述了癌细胞通常无法从其代谢前体同型半胱氨酸合成蛋氨酸,而是依赖外源性摄入蛋氨酸来生长的现象。此外脂质代谢改变也是癌症的一个常见特征。通过了解癌细胞的必需营养物质和代谢特点,相应地改变饮食可以限制肿瘤特定的营养需求,调整某些针对肿瘤代谢脆弱性的营养素[1]。
2、激素调节
营养成分和营养状况可调控体内激素的分泌,以维持不同条件下体内的代谢活动。许多与癌细胞增殖和存活有关的途径都是通过营养敏感激素调节的,如瘦素、胰岛素、胰岛素样生长因子1和类固醇激素,这些激素在饮食的抗癌作用中起着重要作用。
3、肠道微生物
肠道微生物组是肠道健康和免疫功能的关键调节因素,它的生态失调与某些类型的癌症发生密切相关。大量的临床前模型研究报告了微生物组与癌症的发生、发展和对治疗的反应之间的关联。如特定细菌菌株的种群与胆囊癌、胆管癌和胃癌相关的慢性炎症有关;在反复使用抗生素之后肠道微生态失调与各种癌症的风险增加有关;已经证实肠道微生物组有助于免疫疗法的疗效等。微生物组是口服物质(如营养素和药物)的接触点之一,因此微生物组容易受饮食影响,所以微生物组与癌症之间的这种关联为人类研究中的饮食干预提供了有吸引力的目标。
4、免疫系统
肿瘤生长和治疗反应的主要决定因素之一是癌细胞与免疫之间的相互作用。当免疫失调或肿瘤发展出现免疫逃逸时,对抗肿瘤治疗更有可能出现耐药性。补充特定微量营养素和代谢物对免疫功能的维持和增强至关重要,如精氨酸(参与巨噬细胞极化)、硒(T细胞免疫调节剂)、维生素A/C/D(T细胞分泌、成熟等)。饮食干预可增强抗肿瘤免疫力已被多次证明。
二、饮食干预治疗肿瘤的现状
饮食干预有多种形式, 一些侧重于内容,例如能量(热量)限制或常量营养素控制,而另一些则根据时间来定义,例如间歇性禁食方案,这类方案无论膳食成分如何,都会给予完全或部分能量限制的时间间隔。下面具体介绍几种饮食干预途径在癌症治疗中的作用及相关机制、在临床前、早期临床研究中的进展[2](图1)和现状。
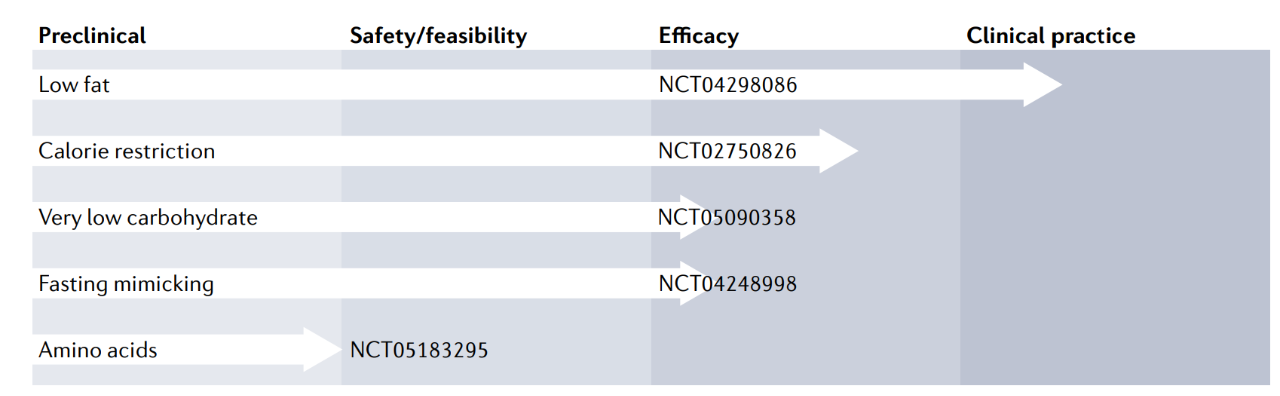
图1 癌症饮食干预的发展进展
1、热量限制
热量限制饮食(Calorie Restriction, CR)是一种通过限制总热量摄入来改变饮食模式的策略。近年来,越来越多的研究表明,CR在癌症治疗中具有潜在的益处,并且可以与其他治疗手段相结合,提高治疗效果。CR干预旨在将热量摄入限制在10-40%之间,同时保持均衡的营养摄入以预防营养不良。CR已被证明可以延长多种生物的寿命和健康跨度,并预防或减少许多炎症和年龄相关疾病的发生,例如2型糖尿病、神经退行性疾病和癌症。自 1990年代初期以来,研究人员已经在小鼠模型中观察到热量限制的益处。除了降低小鼠的肿瘤发生率外,热量限制还可以减缓癌症的进展,降低转移的发生率。例如,CR可以更好地防止乳腺和肠道肿瘤的生长和转移。其机制是多效的,CR会减少胰岛素,从而降低肿瘤PI3K信号及其下游的级联反应水平以降低恶性肿瘤的发生发展。
2、禁食、间歇性禁食和模拟禁食饮食
禁食(Fasting)的目的是在较短的时间内完全减少热量摄入,导致循环葡萄糖和糖原储存在约24小时后耗尽,随之而来的是肝脏中的脂质动员和脂肪酸氧化。这个过程导致许多与CR观察到的相同的现象,包括葡萄糖、胰岛素和瘦素的减少,胰高血糖素、脂联素和酮体的增加,以及IGF-1信号的减少和对活性氧抵抗力的改善。在接受化疗的癌症患者中,禁食降低了促肿瘤激素水平,减少了肿瘤不良事件并改善了患者的生活质量,禁食还改变了外周免疫细胞的丰度来达到抗肿瘤作用。然而,长时间禁食很难维持,并可能导致患者出现营养不良等不良事件。因此许多当前的方法是利用饮食策略来模拟禁食并触发相同的代谢反应。
间歇性禁食(intermittent fasting, IF)是一种广泛使用的模拟禁食效果的方法。目标是维持足够长时间的禁食状态,以诱导机体向脂肪酸氧化和酮症的代谢转变。研究发现周期性IF可抑制肿瘤发生和生长阻滞,并可以与抗肿瘤治疗起到协同作用。
模拟禁食饮食(Fasting-Mimicking Diet, FMD)是具有非常严格的热量限制 (>50%)、高脂肪和低蛋白质的饮食。FMD 治疗可促进健康衰老和代谢健康,在多种癌症模型中具有抗肿瘤作用,并与多种癌症疗法协同作用。
3、低碳水化合物饮食
低碳水化合物饮食(Low-carbohydrate Diet, LCD)是一种以限制碳水化合物摄入量为主的饮食模式,其中生酮饮食(Ketogenic Diet, KD)或极低碳水化合物饮食,是当前癌症治疗领域最有前途的干预措施之一。KD是一种低碳水化合物、高脂肪的饮食模式,重点是最大限度地限制碳水化合物的摄入,以确保长期限制葡萄糖的可用性,使身体进入酮症状态。在严格限制碳水化合物的同时保持等热量摄入既可以利用癌症的代谢特征,又可以在较长时间内最大限度地发挥脂肪酸氧化和酮症的益处。
KD 根据脂肪和蛋白质的含量不同又有不同方案。标准KD的基础是摄入约80%的脂肪、10%的蛋白质和<1%的碳水化合物(95%的卡路里来自脂肪),同时额外补充维生素和矿物质,以避免营养不良。标准 KD 已在癌症的临床前模型中得到广泛研究,并在肝癌、结直肠癌、胰腺癌、恶性神经胶质瘤上出现了显著的抑癌效果。理论上,肿瘤细胞不能利用酮体,生酮治疗应该对所有肿瘤都有效,但是事实并非如此,这提示我们肿瘤细胞的酮体代谢模式有极强的个体异质性。代谢模式的异质性分析是找到生酮治疗疗效差异的解决路径之一,明确代谢亚型和阐明潜在的代谢重编程对于推进生酮精准治疗至关重要[3](图2)。
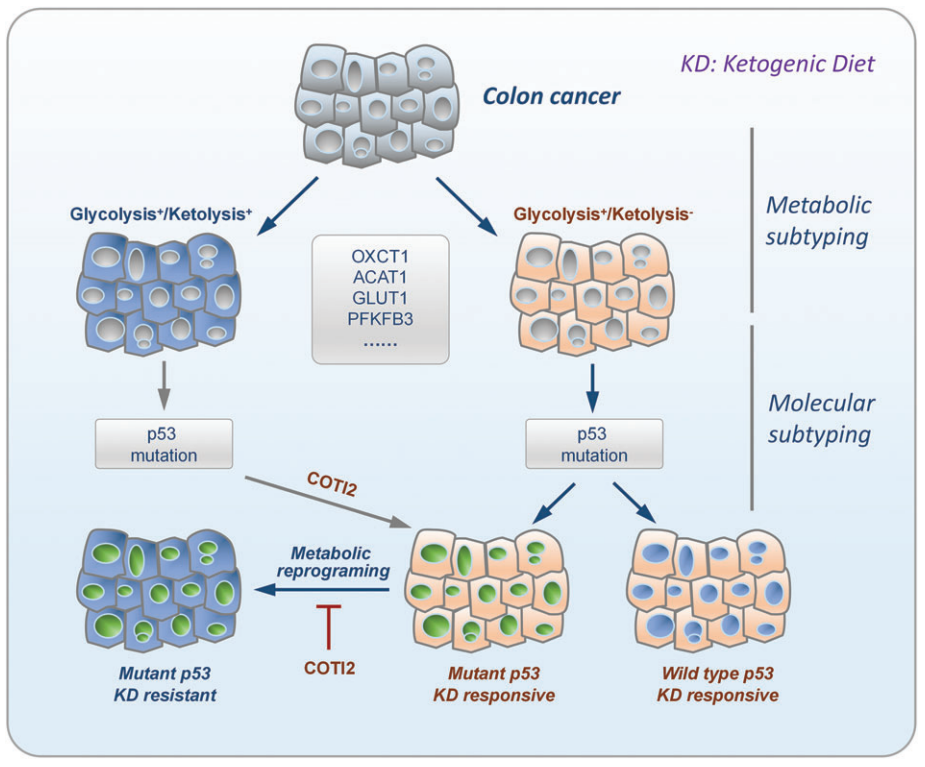
图2 生酮治疗敏感性机制
4、低脂饮食
低脂饮食(Low-fat diet,LFD)是将脂肪摄入量限制在每天总热量的30%以下,并强调蔬菜、水果和全谷物的摄入量。LFD不仅可以安全地使健康受试者达到减轻体重、减少脂肪和降低血液胆固醇的目的,还对癌症患者大有裨益。一项名为妇女健康倡议饮食调整试验的前瞻性随机对照研究表明LFD降低了绝经后乳腺癌患者的死亡率[4](图3)。
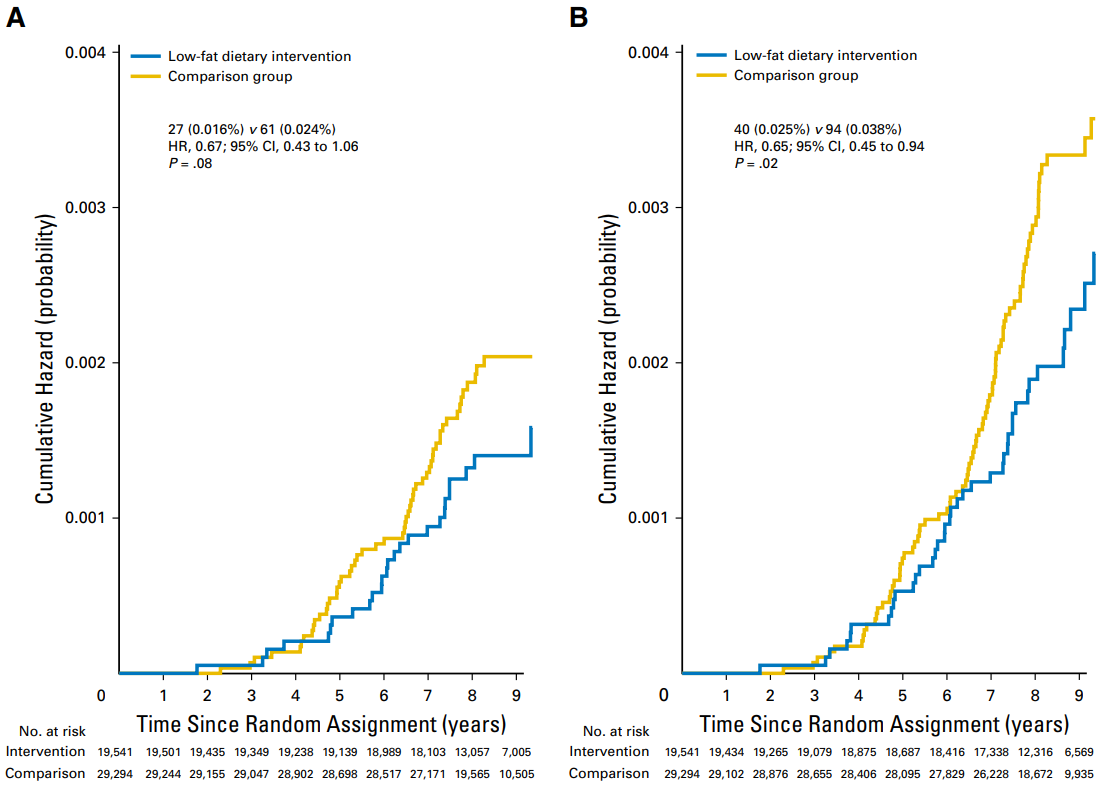
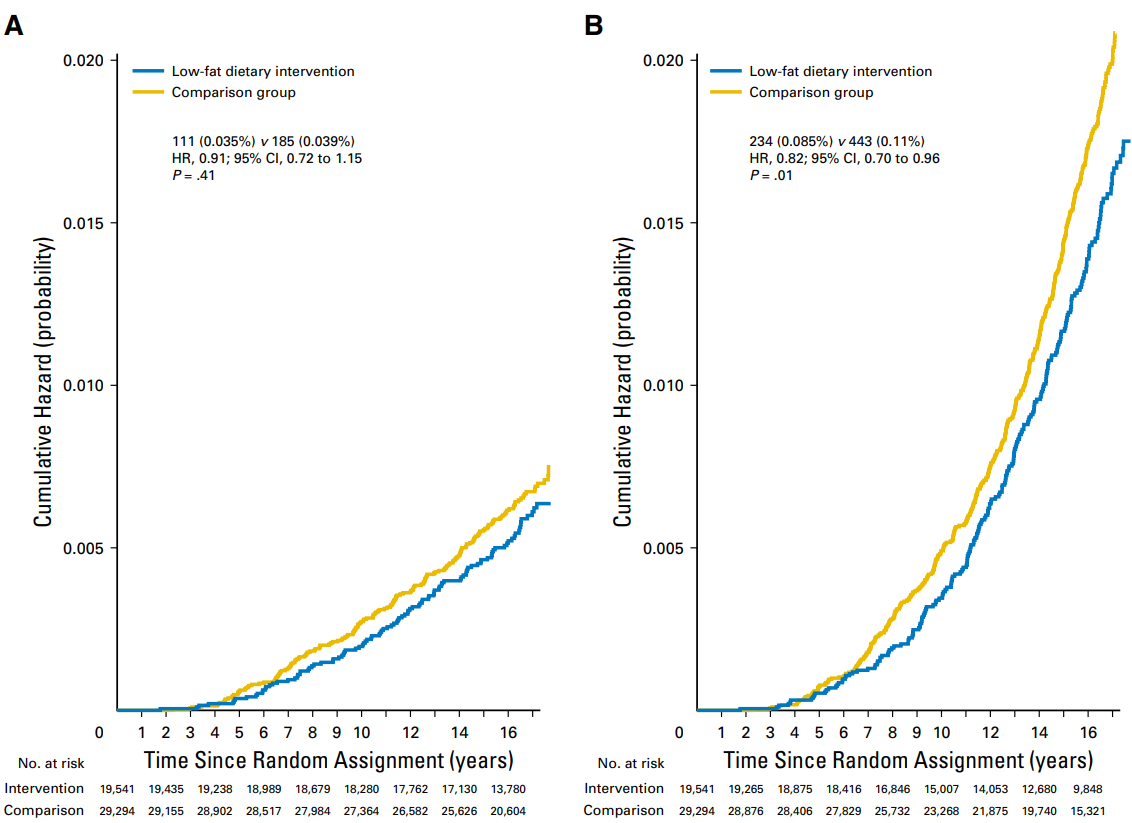
图3 LFD干预降低乳腺癌死亡率
5、其他饮食干预
此外,还有许多其他饮食干预也可能达到阻碍肿瘤生长的目的。例如氨基酸限制饮食,丝氨酸、甘氨酸、半胱氨酸和甲硫氨酸等特定氨基酸的消耗在临床前模型中已经显示出良好的抗癌功效。限制这些氨基酸摄入会耗尽肿瘤中一碳代谢所必需的前体,从而抑制肿瘤生长。
三、饮食干预治疗肿瘤的未来
建议对于不同组织学和分子特征的肿瘤亚型进行不同的饮食干预(表 1)。例如, ER +乳腺癌经常发生PIK3CA突变以逃避激素治疗,这些患者可能受益于将激素和 PI3K 抑制剂疗法与极低碳水化合物饮食相结合,从而降低胰岛素水平并降低肿瘤维持快速摄取营养的能力。相比之下,由于三阴性乳腺癌可能更依赖于外源性脂肪酸,因此低脂饮食可能是更好的干预措施。果糖和膳食脂肪可促进结直肠癌生长,因此不添加糖分的植物性低脂饮食可能适合这些患者。同时,胰腺癌细胞依赖于外源性不饱和脂肪酸,因此热量限制或饱和脂肪含量特别高的极低碳水化合物饮食可能有效。
表 1 未来研究的潜在饮食干预和临床治疗手段配对
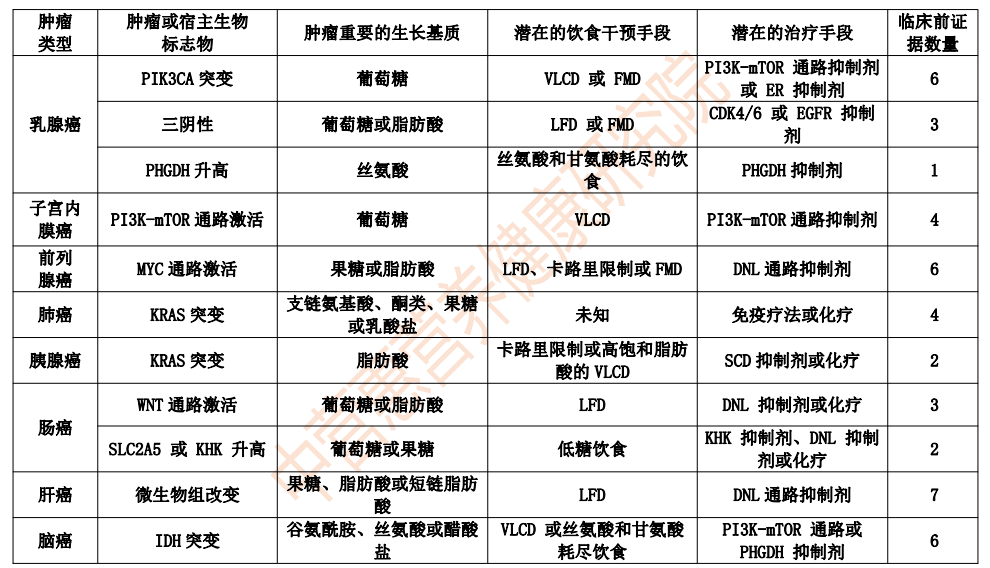
注:BCAA,支链氨基酸;CDK4/6、细胞周期蛋白依赖性激酶4 (CDK4) 和 CDK6;DNL,从头脂肪生成;EGFR,表皮生长因子受体;ER,雌激素受体;FMD,禁食模拟饮食;IDH,异柠檬酸脱氢酶;KHK,酮己糖激酶;LFD,低脂饮食;PHGDH,磷酸甘油酸脱氢酶;SCD,硬脂酰辅酶 A 去饱和酶;SLC2A5,溶质载体家族2成员5;VLCD,极低碳水化合物饮食。
饮食干预还应与协同药理学疗法相结合,其治疗效果更佳。当禁食模拟饮食和极低碳水化合物饮食分别与 CDK4/6和PI3K抑制剂配对时,小鼠肿瘤长期抑制并消退。氨基酸耗尽饮食和不饱和脂肪含量低的饮食与代谢酶抑制剂(如PHGDH和 SCD)的组合在小鼠和人类研究中也得到支持。未来的研究建议通过基于肿瘤组织来源、遗传改变以及与全身激素和代谢物的特征来设计和测试饮食-药物联合疗法的研究来最大限度地提高成功的可能性。
作者简介
石汉平 教授
首都医科大学附属北京世纪坛医院普外四科主任、临床营养科主任,博导,国家市场监管重点实验室(肿瘤特医食品)主任,肿瘤代谢与营养北京国际科技合作基地主任,国家重点研发计划项目首席科学家,北京市战略人才及团队。发表专业论文651篇,其中SCI论文192篇;编写专著65部,其中主编33部,参与编写国家统编教材6部;授权发明专利14项。以第一获奖人获省部级科技进步一等奖3项、二等奖2项、三等奖1项。获“全国优秀科技工作者”“科学中国人”“全国优秀科普工作者”“外科学、肿瘤营养学全国首席科学传播专家”“健康中国(2019年度)十大人物“荣誉称号。
邓丽 助理研究员
首都医科大学附属北京世纪坛医院临床营养科,国家市场监管重点实验室(肿瘤特医食品)常务副主任。博士,长期从事医学基础研究。主持3项省部级课题,市级课题一项;参与国家973一项,国家重点研发项目一项,自然科学基金的研究5项;获得省部级科研奖励二等奖一项;发表SCI论文16篇。中文核心/科技核心5篇。
参考文献
[1] Kanarek N, Petrova B, Sabatini DM. Dietary modifications for enhanced cancer therapy[J]. Nature, 2020, 579(7800): 507-517.
[2] Taylor SR, Falcone JN, Cantley LC, Goncalves MD. Developing dietary interventions as therapy for cancer[J]. Nat Rev Cancer, 2022, 22(8): 452-466.
[3] Tang M, Xu H, Huang H, et al. Metabolism-Based Molecular Subtyping Endows Effective Ketogenic Therapy in p53-Mutant Colon Cancer[J]. Adv Sci (Weinh), 2022, 9(29): e2201992.
[4] Chlebowski RT, Aragaki AK, Anderson GL, et al. Low-Fat Dietary Pattern and Breast Cancer Mortality in the Women's Health Initiative Randomized Controlled Trial[J]. J Clin Oncol, 2017, 35(25): 2919-2926.
[5] Martínez-Garay C and Djouder N. Dietary interventions and precision nutrition in cancer therapy[J]. Trends in Molecular Medicine, 2023, 29(7): 489-511.
doi: 10.1016/j.molmed.2023.04.004.

